Autore
Umberto di Porzio – Gian Carlo Bellenchi
Umberto di Porzio Laboratorio di Neurobiologia dello Sviluppo dell’Istituto di Genetica e Biofisica “Adriano Buzzati Traverso” di Napoli / Gian Carlo Bellenchi CNR di Napoli
Umberto di Porzio è direttore del Laboratorio di Neurobiologia dello Sviluppo dell’Istituto di Genetica e Biofisica “Adriano Buzzati Traverso” di Napoli / Gian Carlo Bellenchi è ricercatore presso l’Istituto di Genetica e Biofisica “A. Buzzati Traverso” del CNR di Napoli
Indice
- Una nuova arca di Noè
- Il verme più elegante della storia
- Molluschi e memoria
- Mosche, linguaggio e canarini
- L’importanza dei topi
- Etica della sperimentazione e bioetica antiriduzionistica
S&F_n. 03_2010
- Una nuova arca di Noè
Agli inizi degli anni sessanta sembrava che la biologia molecolare, mediante lo studio dei microrganismi, avesse fornito la risposta a quasi tutti i principali quesiti della biologia, o almeno quelli fondamentali. Sebbene gli avanzamenti della conoscenza scientifica dei venti anni precedenti fossero stati travolgenti, non si sospettava a quali ulteriori cambiamenti rivoluzionari sarebbe andata incontro la nostra comprensione della genetica e dei processi di espressione genica nei successivi quarant’anni (DNA ricombinante, animali e piante geneticamente modificati, sequenziamento dei genomi, identificazione di molti geni-malattia nell’uomo). Nel 1963 il futuro premio Nobel Sidney Brenner scriveva:
Sono giunto alla convinzione che gran parte della biologia molecolare sia ormai chiara e che dobbiamo passare ad altri problemi della biologia che siano nuovi, misteriosi ed eccitanti, come lo sviluppo e il sistema nervoso.
E, più avanti:
Parte del successo della genetica molecolare è dovuto all’uso di organismi estremamente semplici che possono essere manipolati in gran numero: i batteri e i virus batterici. I processi di replicazione e trascrizione genica, di ricombinazione genica e di mutagenesi, e la sintesi di enzimi poterono essere studiati lì, nella loro forma più elementare, e in seguito si comprese che questi processi erano molto simili nelle forme di vita superiori. Vogliamo affrontare il problema dello sviluppo cellulare in modo simile, scegliere organismi differenziati più semplici possibile e sottoporli ai metodi dell’analisi genetica dei microrganismi[1].
In effetti ciò è stato possibile perché molti meccanismi che controllano lo sviluppo embrionale e le funzioni fisiologiche di un organismo sono straordinariamente ben conservati all’interno del regno animale. Il che convalida largamente l’utilizzo di alcune specie animali anche molto semplici per comprendere molti aspetti della biologia, incluso il sistema nervoso e il cervello umano. Un insieme eterogeneo di esseri che volano, nuotano, si attorcigliano, saltellano o semplicemente vengono spinti dal vento costituiscono gli organismi modello in biologia[2]. Altri sistemi modello non dotati di movimento sono i sistemi cellulari in vitro, incluse le cellule staminali, di cui, per mancanza di spazio, non parleremo. Ugualmente rimandiamo ad altri la descrizione di Arabidopsis thaliana, l’organismo modello di elezione per la genetica e la biologia molecolare e cellulare delle piante. Esula da questa breve rassegna anche la descrizione di modelli artificiali utilizzati per studiare la corteccia cerebrale, le reti di neuroni, idealizzazioni matematiche delle cellule reali, collegati tra loro da equivalenti funzionali delle sinapsi. A essi vogliamo tuttavia rivolgere almeno un breve accenno. Tali modelli sono in grado di mimare le basi neurali delle funzioni cognitive quali la percezione visiva, l’apprendimento e alcuni aspetti della coscienza[3]. Oggi addirittura sono state configurate macchine che possono simulare l’attività di 100 milioni di neuroni con le loro sinapsi, come nel Blue Brain Project in Svizzera, il cui obiettivo è comprendere il codice neurale, cioè come la corteccia processi, conservi e richiami le informazioni [4].
Un organismo modello deve possedere doti di maneggevolezza e di accessibilità che lo rendano facilmente utilizzabile in manipolazioni sperimentali. Gli scienziati infatti utilizzano il termine “modello” per definire un mezzo (nel nostro caso un organismo) utile per fare delle previsioni, che possono essere verificabili mediante esperimenti e osservazioni. In altri termini, è possibile comprendere particolari fenomeni biologici in tali organismi ed estrapolarli per esempio all’uomo in base al presupposto che le acquisizioni fatte sull’organismo modello possono fornire indicazioni sugli altri organismi.
Il primo organismo modello impiegato in esperimenti scientifici è stato il pisello odoroso, o Pisum sativum, il comune pisello da orto che permise a Gregor Mendel di formulare i princìpi fondamentali dell’ereditarietà. Questa pianta infatti rispondeva a specifiche esigenze di incrocio controllato, facile e veloce riproducibilità, progenie numerosa, molteplici varietà disponibili commercialmente, caratteri (fenotipi) differenti e facilmente distinguibili (es. altezza della pianta, colore dei fiori). Queste caratteristiche lo resero ottimale per un approccio ai problemi della ereditarietà di tipo quantitativo e statistico in base alle quali Mendel poté elaborare i ben noti tre principi della genetica.
Nei laboratori di ricerca biomedica s’è formata una novella Arca di Noè della biologia, abitata dai molti organismi oggetto di studio: il vermiciattolo Caenorhabditis elegans, il mollusco marino Aplysia californica o lumaca di mare, il pesciolino Zebrafish (Danio rerio) e la carpa giapponese Medaka (Oryzias lapites), il polpo (Octopus vulgaris), il moscerino della frutta Drosophila melanogaster, il pollo (Gallus), canarini (Serinus canaria) e fringuelli (Taeniopygia guttata), oltre al topo (Mus musculus) e al ratto (Rattus norvegicus). Questi organismi modello si sono rivelati molto utili per l’applicazione di tecniche di biologia molecolare, genetica ed embriologia che hanno rivoluzionato la nostra comprensione dello sviluppo animale e delle funzioni vitali, incluso il sistema nervoso, come aveva predetto Brenner. Essi, come il Pisum sativum di Mendel, sono utilizzabili perché hanno costi di mantenimento relativamente bassi e tempi di gestazione relativamente brevi (24 ore nel moscerino della frutta, 21 giorni nel topo) tali da permetterne lo studio attraverso le generazioni. Le somiglianze genomiche tra questi organismi modello e gli altri animali, incluso l’uomo, insieme alle peculiari caratteristiche succitate, li hanno resi estremamente adatti per l’analisi della fisiologia, del comportamento e di processi di malattia del sistema nervoso. Essi costituiscono i “Sistemi modello”, come sono noti in biologia.
- Il verme più elegante della storia
I contributi dei singoli organismi alle conoscenze del sistema nervoso sono stati immensi, a cominciare dagli studi sull’assone gigante (1 mm di diametro) del calamaro (Loligo pealei). Tali eseprimenti permisero ad Alan Hodgkin e Andrew Huxley di svelare il meccanismo del potenziale d’azione e quindi della trasmissione nervosa negli anni quaranta, i quali per questi studi ricevettero il Premio Nobel insieme a Sir John Eccels nel 1963.
Grazie ai sistemi modello sono state apprese sul cervello e la mente maggiori informazioni negli anni novanta, il cosiddetto decennio del cervello, che durante tutta la storia precedente della neurologia e delle neuroscienze.
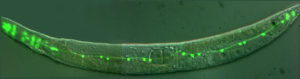

Uno dei top model dei nostri giorni è il nematode C. elegans, costituito da 1090 cellule di cui 302 sono neuroni. Questo verme di 1 mm di lunghezza contiene una serie completa di tessuti differenziati, tra cui il sistema nervoso e un cervello ed è capace di apprendimento e relazioni sociali che lo hanno reso una star negli studi sul comportamento. Anch’esso ha ricevuto il Premio Nobel nel 2002 per gli studi di S. Brenner, J.E. Sulston e R.H. Horvitz sullo sviluppo e sulla morte cellulare, chiamata apoptosi. Quest’ultima è un processo di normale eliminazione di cellule durante lo sviluppo mediante attivazione di una cascata genica. Sue perturbazioni portano a gravi malattie: le cellule tumorali sfuggono a questi normali programmi di “suicidio” cellulare, mentre una morte di neuroni non regolamentata è coinvolta in patologie neurodegenerative, tra cui la malattia di Alzheimer e il morbo di Parkinson. Al piccolo verme si deve anche la scoperta della possibilità di inattivare un gene mediante dei piccoli RNA a doppia elica che destabilizzano l’RNA messaggero o ne impediscono la traduzione in proteina, fenomeno noto come interferenza dell’RNA o RNAi. Anche la scoperta dell’RNAi ha condotto i due principali autori, Andrew Fire e Craig C. Mello al Premio Nobel nel 2006. Molti dei geni essenziali nel funzionamento del sistema nervoso sono stati identificati grazie all’utilizzo di C. elegans. Mediante un approccio di mutagenesi chimica Brenner fu infatti in grado di identificare una serie di mutanti non letali a cui diede il nome di unc (dall’inglese uncoordinated). Questi mutanti presentavano difetti nella mobilità di gravità variabile fino alla paralisi. Il fenotipo era causato da mutazioni che l’agente chimico inseriva in maniera casuale in specifici geni. Alcuni di essi vennero identificati come coinvolti nella contrazione muscolare mentre altri nei meccanismi di neurotrasmissione. L’identificazione di quest’ultima sottoclasse permise di comprendere le loro specifiche funzioni in C. elegans e l’isolamento dei geni omologhi in organismi più complessi come roditori o l’uomo fece compiere un enorme passo avanti verso la comprensione dei meccanismi alla base del funzionamento delle sinapsi, vale a dire le strutture dei neuroni a livello delle quali avviene la trasmissione dell’impulso nervoso.
I nematodi ci hanno anche aiutato a capire alcuni dei meccanismi molecolari dell’apprendimento. Infatti i nematodi si cibano di batteri e se si forniscono batteri patogeni essi possono imparare ad associare stimoli chimici con la malattia ed evitare questi stimoli se hanno la possibilità di scelta. Le conoscenze di singoli neuroni e circuiti di questo organismo sperimentale hanno permesso di individuare i neuroni responsabili di questo comportamento e il neurotrasmettitore richiesto, la serotonina.
Inaspettatamente, proprio al verme si devono i primi dati molecolari su un tratto molto complesso, la socialità. Infatti C. elegans può presentare due comportamenti alimentari, cibandosi in isolamento (alimentazione solitaria) o in gruppo (alimentazione in gruppo). È stato scoperto che l’alimentazione sociale è indotta da neuroni che consentono di rilevare condizioni negative o stressanti, chiamati nocicettivi. L’ablazione di questi neuroni trasforma i vermi sociali in solitari. Sono stati individuati i geni coinvolti e le vie metaboliche intracellulari necessarie a promuovere l’alimentazione sociale o a inibire l’aggregazione[5].
È evidente che un comportamento complesso come la socialità o riservatezza non dipende da singoli geni ma è il prodotto di una catena di informazioni che modifica un circuito mediante l’azione su geni e proteine. Uno studio recente su 1100 coppie di gemelli umani mono- o di-zigoti indica che socievolezza o tendenza all’isolamento avrebbero una base ereditaria. Tali geni contribuirebbero a determinare non solo il comportamento del singolo individuo, ma l`intera rete delle relazioni sociali. Essere solitario o socievole deriverebbe dalla selezione naturale: per esempio in caso di una epidemia letale, gli individui solitari, ai margini del gruppo, avrebbero avuto maggiori possibilità di sopravvivere e così tramandare alla progenie i geni responsabili di questo comportamento[6].
- Molluschi e memoria
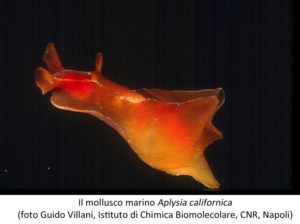
Ancora agli organismi modello dobbiamo le prime indicazioni sui meccanismi molecolari e cellulari della memoria. Importanti informazioni sono venute da molluschi marini Aplysia e il polpo. Il premio Nobel Eric Kandel aveva iniziato gli studi sulla memoria utilizzando dei mammiferi, ma ben presto si rese conto che la loro complessità era tale da impedire la comprensione degli eventi molecolari alla base di questi fenomeni e decise di utilizzare per le sue ricerca la più semplice lumaca di mare. Questo mollusco ha un sistema nervoso formato da 20000 neuroni, raggruppati in gangli, incommensurabilmente pochi rispetto ai cento miliardi che popolano il cervello umano, ma con corpi cellulari di taglia enorme fino a centinaia di micron[7].
Gli esperimenti di Kandel e collaboratori permisero di dimostrare che le modificazioni chimiche che avvengono alle sinapsi durante la trasmissione dell’impulso nervoso sono alla base degli eventi di apprendimento e memoria. In particolare Kandel osservò che mentre la memoria a breve termine richiede eventi come la modificazione di proteine esistenti (per esempio la fosforilazione), per la memoria a lungo termine sono richiesti cambiamenti della struttura della sinapsi con sintesi di nuove proteine. Tali osservazioni pionieristiche furono poi confermate dallo stesso Kandel sia in roditori che nell’uomo tanto che oggi è possibile studiare come le memorie complesse sono conservate nel nostro sistema nervoso e come sia possibile ricreare il ricordo di eventi avvenuti precocemente. La comprensione degli eventi cellulari e molecolari che ci permettono di ricordare ha aperto la frontiera dello sviluppo di nuovi farmaci capaci di migliorare le funzioni cerebrali in pazienti affetti da diversi tipi di deficit cognitivi.

Il polpo è un mollusco cefalopode con un sistema nervoso formato da circa cinquecento milioni di neuroni, la metà dei quali forma il cervello. Il polpo è stato utilizzato come modello di memoria e apprendimento sia in studi recenti che in lavori risalenti alla prima metà del novecento. I polpi infatti sono in grado di risolvere problemi logici, come per esempio svitare il tappo di un barattolo per mangiare un gamberetto in esso contenuto e possono apprendere a farlo osservando altri polpi compiere questa operazione. Essi posseggono sia memoria a breve termine che a lungo termine con meccanismi simili a quelli dei vertebrati. In mare, per cibarsi di un bivalve, sono capaci di raccogliere un sassolino e inserirlo tra le valve prima che la preda le serri, oppure possono raccogliere oggetti occasionali e usarli come scudi protettivi. Questi bellissimi animali, che ahinoi spesso troviamo sulle nostre tavole, rappresentano quindi un eccellente modello per l’analisi dell’evoluzione dei meccanismi di apprendimento e memoria.
- Mosche, linguaggio e canarini

Il “signore delle mosche” è il moscerino Drosophila melanogaster, già al centro degli studi sul ruolo dei cromosomi nell’ereditarietà e sul comportamento dell’accoppiamento condotti dal pioniere degli studi su questo animale sin dalla prima decade del novecento, Theodore Hunt Morgan, premio Nobel nel 1933.
Seymour Benzer e il suo collaboratore Ron Konopa isolarono nel 1971 la prima mutazione genetica capace ci influenzare il comportamento di un animale, alterandone il ritmo di attività e riposo nelle 24 ore, generando “mutanti orologio”[8]. Della Drosophila il fondatore della neurogenetica era solito dire: «non solo può adempiere a comportamenti sofisticati quali apprendimento, corteggiamento, mantenere il tempo, come quelli umani, ma può anche camminare sui muri e volare». Il moscerino della frutta, che così tanto ha contribuito alle nostre conoscenze di genetica e dello sviluppo degli organismi, si è rivelato anche un eccellente modello sperimentale per studiare la tumorigenicità, la neurodegenerazione e longevità. Per esempio recentemente è stato possibile generare insetti in cui solo in alcune cellule veniva eliminata l’espressione di un gene soppressore tumorale chiamato LATS1. Solo in queste cellule si sviluppa il tumore, e ciò può essere impedito reintroducendo LATS1. Ancora in Drosophila è stato identificato un gene che ha un ruolo importante nello sviluppo embrionale e nella longevità (aumentandola), modificando il metabolismo di una famiglia di molecole lipidiche, i ceramidi. Anche gli studi in questo moscerino hanno contribuito alla comprensione dei meccanismi di apprendimento e memoria, che sono comparabili a quelli di Aplysia, dei mammiferi e dell’uomo. Il cervello di questo moscerino comprende circa 200.000 neuroni, due terzi dei quali sono deputati ai processi visivi, tant’é che l’occhio della Drosophila è estremamente sofisticato.
Il cervello degli animali modello può essere molto complesso con funzioni vicine a quelle del cervello umano, come il linguaggio.

Gli uccelli canterini sono i soggetti più studiati per l’analisi di questa funzione, per lo studio della sua comparsa nel corso dell’evoluzione, per la comprensione dei meccanismi di apprendimento e il raggiungimento della sua complessità. I pionieristici studi degli anni Settanta-Ottanta del Novecento del gruppo di Fernando Nottebohm al Rockfeller Institute a New York, hanno permesso di scoprire che nel cervello di questi uccelli, come i canarini (Serinus canaria) e i fringuelli (per esempio il diamante mandarino Taeniopygia guttata), vengono generati nuovi neuroni che differenziano e si integrano nei circuiti deputati all’apprendimento, al controllo e all’esecuzione del canto. Così venne dimostrato per la prima volta che il cervello di un vertebrato adulto era capace di generare nuovi neuroni e che questi ultimi erano in grado di integrarsi in circuiti preesistenti. Questo processo era necessario all’apprendimento del canto. Fu grazie a questo modello animale che si poté provare inequivocabilmente che esistono cellule staminali che producono nuovi neuroni anche in un cervello adulto, e che tali nuovi neuroni svolgono importanti funzioni. L’esistenza della neurogenesi nel cervello di un animale adulto venne in seguito confermata nei mammiferi, incluso l’uomo. È accertato oggi che la neurogenesi nel cervello adulto è necessaria alla memoria e all’apprendimento, che può essere stimolata positivamente da attività fisica, ambiente stimolante, farmaci, tra cui alcuni antidepressivi, o eventi patogeni come ischemia cerebrale o epilessia. Inversamente, la neurogenesi viene negativamente influenza da vari fattori, tra cui lo stress e l’invecchiamento. Queste scoperte hanno rivoluzionato il concetto stabilitosi nelle neuroscienze sin dalla fine dell’Ottocento secondo cui dopo lo sviluppo embrionale nel cervello non è possibile nuova crescita, e hanno aperto la strada a nuovi approcci terapeutici per riparare il cervello danneggiato grazie alle cellule staminali. In esse potrebbe essere contenuto anche il segreto per indurre il ringiovanimento del cervello[9].
- L’importanza dei topi

Secondo Steinbeck uomini e topi sarebbero abbastanza simili. Nel libro con questo titolo i piani architettati da entrambi spesso sortiscono cattivo esito e invece della gioia promessa arrecano dolore e sofferenza[10]. Anche per gli scienziati vi è analogia tra uomini e topi, ma non di tipo progettuale ed emotivo, ma piuttosto genetica (85-88% di omologia di DNA), di meccanismi di sviluppo e di comportamento. Il 90% degli esperimenti condotti oggi nei laboratori di biologia sono eseguiti sul topo, sebbene il ratto rappresenti spesso un miglior modello di malattia umana e in particolare di malattie neurologiche e psichiatriche.
Il topo è un animale indispensabile nei laboratori di ricerca, specie da quando nel 1980 fu generato il primo topo transgenico, geneticamente ingegnerizzato per sviluppare cancro mediante iniezione di un pronucleo nell’uovo fecondato. Nel 1987 fu generato il primo topo knock-out, in cui si era ottenuta l’ablazione di un gene. Inattivando specifici geni, i ricercatori hanno anche progettato topi che sviluppano una serie di condizioni patologiche, compreso il cancro, la fibrosi cistica, l’aterosclerosi o malattie neurodegenerative. I topi modificati hanno permesso ai ricercatori una visione senza precedenti sul modo in cui alcune delle più invalidanti malattie umane progrediscano nei diversi tessuti e organi nel corso della vita, e si sono dimostrati preziosi in fase di test di nuove terapie farmacologiche. Più di 500 diverse malattie sono state riprodotte nei topi utilizzando questa tecnica. Nel 2007, Mario R. Capecchi, Sir Martin J. Evans, Oliver Smithies furono insigniti del Premio Nobel per questa scoperta. A volte tuttavia l’eliminazione di un gene dall’organismo in studio non è possibile perché esso è essenziale alla vita delle cellule o dell’organismo stesso. In alcuni casi inoltre l’eliminazione di un gene fa sì che un altro gene con funzione simile ne possa vicariare la funzione (ridondanza genica). Per aggirare questa limitazione è possibile generare “mutanti condizionali”, in cui il gene è attivo in una determinata condizione ambientale e non in un’altra. Già usate nello studio dei batteri, dove è possibile rendere inattivo un gene a una determinata temperatura, le mutazioni condizionali permettono di attivare o inattivare un gene in un determinato momento dello sviluppo embrionale o della vita di un organismo e anche solo in determinate cellule e neuroni, ma non in altri, fornendo così un modello di manipolazione genetica scevro dai problemi enunciati. In aggiunta, allo scopo di identificare in quali cellule dell’organismo o del sistema nervoso sia presente il prodotto codificato da un determinato gene è possibile sostituire il gene di interesse con un gene reporter che viene espresso al posto del gene candidato. Generalmente questo gene reporter presenta il vantaggio di essere facilmente identificabile mediante comuni tecniche di laboratorio. Questa procedura è detta knock-in e comporta l’inattivazione del gene endogeno bersaglio. Uno dei transgeni reporter più utilizzati è quello codificante per la proteina fluorescente GFP (Green Fluorescent Protein), inizialmente isolata nella medusa Aequorea victoria. Questa proteina permette sia di individuare le cellule e le aree dell’organismo in cui il gene endogeno è specificamente espresso e la cadenza temporale della sua attivazione, sia di isolare mediante opportune tecniche di cromatografia a fluorescenza le cellule positive, separandole così da quelle che non lo esprimono.
L’uso di organismi modello in biologia si va estendendo a problematiche inimmaginabili fino a pochi decenni fa. Incredibilmente, recenti esperimenti sul topo hanno iniziato a far luce sul linguaggio umano e sulla sua evoluzione. Il fattore di trascrizione Foxp2 è fortemente conservato nell’evoluzione e la proteina dell’uomo diverge per due aminoacidi da quella della scimmia e per tre da quella del topo. Nell’uomo mutazioni di questo gene sono collegate a disturbi del linguaggio (disprassia). In un modello murino in cui è stato sostituito il gene del topo con quello che codifica per la forma umana si è osservato che i topi emettono ultrasuoni più profondi dei controlli normali. Del resto Foxp2 è preferenzialmente espresso nelle aree del cervello che sono implicate anche nel linguaggio. In questi topi si osservano modifiche nel sistema dei gangli della base, con aumento della plasticità sinaptica, opposte a quelle osservate nei topi con una sola copia di Foxp2 e nei soggetti umani affetti da disprassia per mutazione in un allele di questo gene. Si può supporre che gli effetti osservati nei circuiti corticali e gangli della base nei topi con Foxp2 umano possano essere un modello per alcuni aspetti dell’insorgenza della parola e dell’evoluzione del linguaggio nell’uomo. Del resto che Foxp2 sia implicato nell’acquisizione del linguaggio sembra confermato da studi sugli uccelli canori, nei quali l’ablazione di questo gene blocca l’apprendimento del canto. Si può presumere dunque che dal topo e dagli uccelli potrà svilupparsi una chiave interpretativa dello sviluppo della parola e del linguaggio nell’uomo e come questo abbia contribuito alla sua evoluzione[11].
- Etica della sperimentazione e bioetica antiriduzionista
Va inoltre considerato il ruolo importante ricoperto dai modelli animali per lo studio di malattie neurologiche degenerative. Queste ultime colpiscono specifiche popolazioni di neuroni, come nella Malattia di Parkinson, Corea di Huntington, Paralisi Sopranucleare Progressiva, o sono più generalizzate come nella malattia di Alzheimer. Lo studio nei piccoli animali di laboratorio delle alterazioni del sistema nervoso, siano esse su base genetica che sporadiche, ha permesso di individuare sia alcuni meccanismi di morte cellulare dei neuroni comuni a tutte le neurodegenerazioni sia alcuni specifici di una determinata malattia, consentendo così di sperimentare potenziali terapie all’avanguardia, come quella genica e quella rigenerativa. La prima consente l’introduzione di geni specifici nelle cellule di un individuo che sostituiscano quelli alterati per curare determinate malattie e la seconda si basa sulla possibilità di rigenerare il tessuto nervoso e specifici popolazioni di neuroni immettendo nell’organismo malato (o direttamente nel cervello e midollo spinale) cellule staminali di origine nervosa o da altri tessuti, come quello ematopoietico[12].
L’impiego di organismi standardizzati nel campo della biomedicina è parte di un modello più ampio, vale a dire di un approccio sistematico nelle scienze della vita che permette l’indagine su un’ampia gamma di soggetti. Va detto che i sistemi modello mantengono una propria autonomia e specificità e la loro utilità nella produzione di conoscenza generale si basa sulla validità delle analogie. Cioè i sistemi modello sono lontani dagli approcci tradizionali di altri modelli scientifici che per esempio in fisica teorica sono pura rappresentazione del fenomeno in analisi.
L’uso di animali nella pratica della ricerca scientifica apre il dibattito sulla sperimentazione animale. Innanzitutto va detto con chiarezza che la vivisezione è oggi completamente bandita dai laboratori di ricerca e che in ogni paese occidentale esiste una legislazione rigorosissima in merito. L’uso di modelli animali è necessario ancor più negli studi sul cervello perché, secondo gli scienziati e i ricercatori, la complessità d’integrazione cellulare presente nel sistema nervoso centrale non può essere dedotta dalla funzione dei singoli componenti. Mentre si invoca la sostituzione della sperimentazione animale con simulazioni computerizzate, si ignora che queste necessitano di una conoscenza della funzione biologica e fisiopatologica del sistema nervoso e del cervello. È dunque auspicabile una maggiore complementarietà della sperimentazione in vivo e in vitro e dell’elaborazione informatica per accrescere le nostre conoscenze e favorire anche lo sviluppo di strategie terapeutiche efficaci.
Il nostro ragionamento tende anche a sottolineare che il riduzionismo nelle neuroscienze è necessario per comprendere e localizzare funzioni, attività, collegamenti nervosi.
Nella seguente tabella è indicato il numero di neuroni nel cervello di vertebrati e nei gangli nervosi degli invertebrati[13].
|
Elefante |
200.000.000.000 |
|
Balena |
200.000.000.000 |
|
Uomo |
100.000.000.000 (11 miliardi nella corteccia cerebrale) |
|
Scimpanzè (Pan troglodytes) |
60.000.000.000 (6,2 miliardi nella corteccia cerebrale) |
|
Octopus vulgaris |
500.000.000 |
|
Rattus norvegicus |
150.000.000 (15 milioni nella corteccia) |
|
Mus musculus |
50.000.000 (4 milioni nella corteccia) |
|
Drosophila melanogaster |
200.000 |
|
Aplysia cali fornica |
20.000 |
|
C. elegans |
302 |
È stupefacente che molte funzioni nervose siano comparabili tra un organismo che contiene 302 neuroni in tutto con uno che ne ha cento miliardi solo nel cervello.
Da questi dati risulta anche chiaro che l’identificazione di un gene con una funzione non si attaglia più alla biologia degli esseri viventi e tanto meno a quella del loro cervello. Per esempio, nell’uomo vi sono 25.000 geni, 100 mila proteine, 100 miliardi di neuroni e 100 mila miliardi di connessioni tra questi neuroni, le sinapsi. È evidente che il cervello e le sue complesse funzioni sono il prodotto di un complesso sviluppo durante il quale i geni sono espressi e interagiscono uno con l’altro e con l’ambiente. Per dirla con il noto scienziato britannico Steven Rose, acclamato oppositore del riduzionismo nelle neuroscienze:
Il cervello è un insieme di processi dinamici, parzialmente correlati e parzialmente indipendenti. […] I processi mentali e coscienti sono essi stessi proprietà evolute e funzionalmente adattative essenziali per la sopravvivenza umana: non sono scesi dal cielo e nemmeno sono proprietà addizionali prive di funzione, conseguenze epifenomeniche del possesso di grandi cervelli che non hanno di per sé un potere causale.[14]
Le neuroscienze, mediante gli organismi modello potranno farci avanzare anche nel superamento del dualismo tra mente e corpo, tra mente e cervello, come sostiene il neurologo americano/portoghese Antonio Damasio[15]. Sembra quasi intuitivo che la mente non possa essere indipendente dal cervello, come “Il naso” di Gogol che se ne va a spasso per strada da solo senza la faccia del suo possessore Kovalev, protagonista del racconto. E oggi, attraverso lo studio dei piccoli organismi e la visualizzazione dei cervelli in azione mediante tecniche di neuroimaging, potremo localizzare funzioni, come avviene sin dalla metà del XIX secolo con lo studio di un primo paziente, Phineas Gage. Phineas era un capomastro cui una sbarra di ferro trapassò il cranio, spappolando il lobo frontale sinistro e parte di quello destro, per un incidente mentre lavorava alla costruzione di una ferrovia in Vermont, USA. Il paziente sopravvisse e si riprese completamente ma era psicologicamente “cambiato”, aveva mutato personalità. Aveva perso l’etica del lavoro e la condotta morale che l’aveva caratterizzato fin ad allora. Per la prima volta mutamenti comportamentali furono correlati a un’area precisa di danno nella regione frontale dell’encefalo, al pari delle aree che Broca e Wernicke stavano allora iniziando a definire, grazie alle autopsie di altri pazienti, per funzioni come il linguaggio parlato, la sua elaborazione e comprensione. Da queste osservazioni per la prima volta il comportamento, la morale, la mente, il pensiero furono visti come prodotti di funzioni cerebrali. Questi approcci permetteranno anche di individuare le strutture cerebrali che sottendono i processi mentali. Ma “localizzare” non basta, per spiegare è necessario comprendere i meccanismi neuronali che li sottendono, come sostengono i neuropsicologi Legrenzi e Umiltà[16]. E le neuroscienze hanno ancora molta strada da percorrere.
[1] W.B. Wood and the community of C. elegans researchers (eds.), From The Nematode Caenorhabditis elegans, Cold Spring Harbor Laboratory Press, Cold Spring Harbor 1988.
[2] Cfr. NIH Model organisms for biomedical research: http://www.nih.gov/science/models/.
[3] M. Minsky, La società della mente, tr. it. Adelphi, Milano 1989; T. Gisiger et al, Computational models of association cortex, in «Current Opinion in Neurobiology», 2000; 10:250-9; A. Lansner, Associative memory models, in «Trends in Neurosciences» 2009; 32:178-86.
[4] H. Markram, The blue brain project, in «Nature Reviews Neuroscience» 2006; 7:153–160.
[5] M. De Bono, Molecular approaches to aggregation behavior and social attachment, in «Journal of Neurobiology», 2003; 54:78-92; M. De Bono et al, Social feeding in Caenorhabditis elegans is induced by neurons that detect aversive stimuli, in «Nature» 2002; 419:899-903.
[6] J.H. Fowler et al, Model of genetic variation in human social networks, in «Proceedings of the National Academy of Sciences (USA)», 2009; 106:1720-4.
[7] E. Kandel, The molecular biology of memory storage: a dialogue between genes and synapses, in «Science», 2001; 294:1030-8.
[8] R.J. Konopka, S. Benzer, Clock mutants of Drosophila melanogaster, in «Proceedings of the National Academy of Sciences (USA)», 1971; 68:2112-6.
[9] F. Nottebohm, From bird song to neurogenesis, in «Scientific American» 1989; 260:74-9; L. Colucci D’Amato et al., Un dogma infranto: le cellule staminali neurali e la neurogenesi nel Sistema Nervoso Centrale dell’adulto, in «Darwin» 2005; 9:52-59; L. Colucci-D’Amato e U. di Porzio, Neurogenesis in adult CNS: from denial to opportunities and challenges for therapy, in «Bioessays», 2008; 30:135-45.
[10] J. Steinbeck, Uomini e topi, tr. it. Bompiani, Milano 2005.
[11] S.E. Fisher, C. Scharff, FOXP2 as a molecular window into speech and language, in «Trends in Genetics» 2009; 25:166-77.
[12] U. di Porzio, Le cellule staminali. A che punto siamo?, in F. Lucrezi e F. Mancuso (a cura di), Diritto e vita. Biodiritto, bioetica, biopolitica, Rubbettino, Soveria Mannelli 2010, pp. 577-602.
[13] G. Roth, U. Dicke, Evolution of the brain and intelligence, in «Trends in Cognitive Sciences» 2005; 9: 250–7.
[14] S. Rose, Il cervello del XXI secolo, Codice edizioni, Torino 2005.
[15] A. Damasio, L’ errore di Cartesio, tr. it. Adelphi, Milano 1995.
[16] P. Legrenzi, C. Umiltà, Neuro-mania. Il cervello non spiega chi siamo, Il Mulino, Bologna 2009.